

Whisky, arômes et concentrations
Récemment, deux articles scientifiques de Conner et al. ont retennu mon attention:
Headspace concentrations of ethyl esters at different alcoholic strengths and Release of distillate flavour compounds in Scotch malt whisky (1, 2).
Les titres semblent relativement compliqués et sont-ils intéressant pour l’amateur de whisky “non-scientifique”?
Si vous êtes intéressés à savoir ce qui se passe à votre whisky une fois que vous avez ouvert votre bouteille ou de savoir quel impact peut avoir le volume d’alcool sur le gôut de votre whisky, alors continuez de lire ce rapport.
Dans sa première publication, Conner et al. s’intéresse à la concentration d’ester d’éthyle à différents volumes d’alcool.
Introduction :
« ester d’éthyle » et « espace de tête (headspace) », qu’est ce que c’est ?
Ester d’éthyle
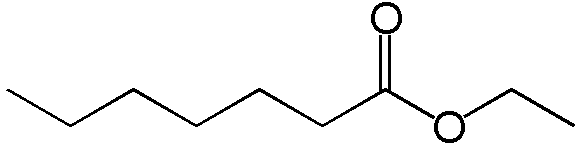
D’un point de vue chimique, le whisky est un produit très sale, composé principalement d’eau et d’éthanol (« alcool », représentant généralement 40-43% du volume d’une bouteille de whisky). Un tel mélange est plutôt sans odeur, alors que le whisky est un produit riche en arômes. Les arômes d’un whisky proviennent d’une multitude de composés chimiques générés pendant les différentes étapes de production du whisky, ainsi que de l’interaction du distillat avec le bois du fût pendant la maturation. Les esters sont les molécules les plus importantes pour les arômes du whisky et contribuent aux arômes tels que l’ananas, la fraise, la pommer ou l’abricot, mais également à des arômes moins plaisants (ex. savonneux). Un exemple de structure chimique d’un ester d’éthyle (EE) est illustré ci-dessous (heptanoate d’éthyle :
Un ester est un assemblage de molécule de carbone (« la vague »), contenant deux atomes d’oxygène (« 0 ») très proches.
Espace de tête
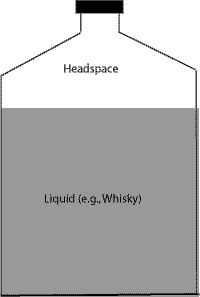
L’espace de tête, ou « headspace » en anglais est le volume d’air se trouvant entre la surface du liquide (ex. whisky) et l’headspace est le volume entre le whisky et le bouchon.
Les résultats
Afin d’évaluer l’effet de la concentration d’alcool sur les concentrations d’ester d’éthyle dans l’espace de tête, les auteurs ont rempli des flacons en verre avec un mélange d’eau et d’éthanol (alcool) à différentes concentrations (entre 5 et 80% d’alcool par volume (ABV)), ainsi que d’une combinaison de différents EE (EE avec différents groupes de méthylène (-CH3)). Après une certaine période de temps, ils ont collecté un échantillon d’air dans l’espace de tête et injecté cet échantillon dans un appareil analytique (chromatographie en phase gazeuse) afin de déterminer la concentration de différents EE volatiles. Ces concentrations dans l’espace de tête sont exprimés en « coefficient d’activité » (activity coefficient).
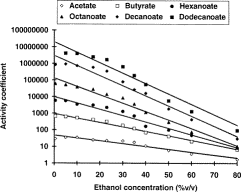
Figure 1 : Effet de l’augmentation de la concentration d’éthanol sur le coefficient d’activité des éthyles d’ester. Copié de (1).
Sur la figure 1, on constate que le coefficient d’activité (CA) augmente lorsque la concentration d’éthanol décroît. Cette augmentation du CA est plus prononcée pour les petites molécules (ex., acétate et butyrate) que pour les grandes (ex., décanoate ou dodecanoate). Cet augmentation est néanmoins plus prononcée sur la partie gauche de l’axe x, que sur la partie droite.
C’est-à-dire ?
En termes plus simple, cela signifie que si l’on réduit la concentration d’éthanol de 15 % (comme dans le vin par exemple) à 5% (bière), cette réduction de la concentration d’alcool a peu d’effet sur le profil aromatique. Cependant, si l’on réduit la concentration d’alcool de 40% à 30-35% ABV, le CA va considérablement augmenter. En d’autres termes, les agréables arômes contenus dans votre bouteille de whisky vont s’échapper dans l’espace de tête, entre le whisky et le bouchon. Ainsi, chaque fois que vous allez ouvrir votre bouteille, ces arômes peuvent s’échapper de votre bouteille et votre whisky va perdre rapidement ses qualités aromatiques. Encore plus important, les petites molécules (les « bonnes » molécules) vont migrer plus rapidement dans l’espace de tête que les grosses (« les mauvaises »). En conséquence, les arômes désagréables (savon, transpiration) seront plus perceptibles.
En conclusion, sur la base de cette étude, lorsque votre whisky perd en volume d’alcool, il va perdre d’abord ces arômes les plus plaisants et les arômes les plus déplaisants vont être plus prononcés.
Plusieurs amateurs de whisky, une fois qu’ils ont ouvert leurs bouteilles et consommés une certaine proportion, transfèrent leur whisky dans des bouteilles plus petites, dans le but d’améliorer la qualité de stockage du whisky.
Dans cette expérience, les espaces de tête sont relativement larges (environ le même volume que la partie liquide). Si l’on réduit l’espace de tête, il se peut qu’un phénomène de saturation puisse se dérouler et ainsi limité la perte des arômes désirables. Il se peut donc que de transférer le whisky au fur et à mesure apparaisse comme une bonne solution. Néanmoins, je suppose que ces EE restent en suspension dans l’espace de tête, entre le liquide et le bouchon, et que des transferts de contenu trop fréquents peuvent avoir les mêmes conséquences que de conserver le whisky dans des bouteilles quasiment vides.
Dans le deuxième article de Conner et al., les auteurs ont étudié les effets de la température et d’extraits de bois sur le coefficient d’activité (CA). Lorsque la température augmente de 20°C à 25°C, les effets sur le CA des EE est légèrement affecté, mais d’avantage marqués lorsque la température augmente à 30°C. Il est intéressant de noter que la présence d’extraits de bois dans la solution d’eau et d’alcool réduit considérablement la concentration d’EE dans l’espace de tête (figure 2). Cela indique que les extraits de bois et autres particules du fût en chêne permettent d’améliorer la stabilité de la solution eau/alcool (« whisky »).
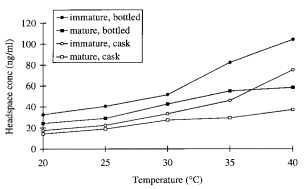
Figure 2 : Concentrations d’éthyle decanoate dans l’espace de tête sur des modèles de whisky en bouteille (bottled) ou en fût (cask) dilués à 23% d’éthanol (V/V) à différentes températures. Copié de (2).
Conclusion générale et discussion
Par loi (au Royaume-uni), le whisky doit être mis en bouteille à au moins 40% ABV. Les taxes sur l’alcool étant fort élevées, les producteurs de whisky mettent en le whisky en bouteille à 40-43% afin de maintenir le prix de la bouteille abordable pour le client. De nos jours, de plus en plus d’amateurs de whisky sont intéressés par les single malts mis en bouteille à la force du fût et non filtrés à froid. Pendant le processus de filtration à froid, certaines molécules d’acides gras sont éliminés par précipitation afin d’éviter la formation de « nuages » dans les whiskies réduits à 40-43%.
Les études de Conner et al. est intéressant, car dans son modèle de whisky, ils ont évalué les effets de différentes variables (concentrations d’éthanol, température et extraits de ois) sur les arômes du whisky (éthyles d’ester). Leurs conclusions sont que la réduction de la concentration d’alcool (ABV) en dessous de 40% nuit au profil aromatique du whisky, que la température a un effet modéré, mais que les extraits de bois permettent d’augmenter la stabilité du whisky lorsque exposé à des facteurs négatifs.
D’une façon plus concrète, si le modèle de Conner est considéré comme représentatif d’une bouteille de whisky, ces résultats suggèrent qu’une bouteille de whisky à 40-43% perde plus rapidement ses qualités aromatiques qu’une bouteille à 46%. De plus, la proportion de bons arômes par rapport aux mauvais, va décroître avec le temps.
En filtrant les particules de bois du whisky, les effets stabilisateurs des particules du bois du fût sont supprimés. En conclusion, un whisky mis en bouteille à la force du fût et non-filtré supporterait un stockage plus long qu’une bouteille de whisky à 40%. Le whisky est une solution plus complexe que le modèle de Conner et al, et puisque l’impact sur les arômes en fonction du temps de conservation n’est pas établit dans ces deux publications, continués de consommer votre whisky à votre rythme et avec modération, mais pensé à finir vos bouteilles ouvertes avant d’ouvrir les autres afin de pouvoir apprécier votre whisky dans les meilleurs conditions de qualité et de sensation.
1. J. M. Conner, L. Birkmyre, A. Paterson, J. R. Piggott, Journal of the Science of Food and Agriculture 77, 121 (1998).
2. J. M. Conner, A. Paterson, J. R. Piggott, Journal of the Science of Food and Agriculture 79, 1015 (1999).
Dr P. Brossard ©Mai 2008